ترجمة وتحرير : د.بسام درويش
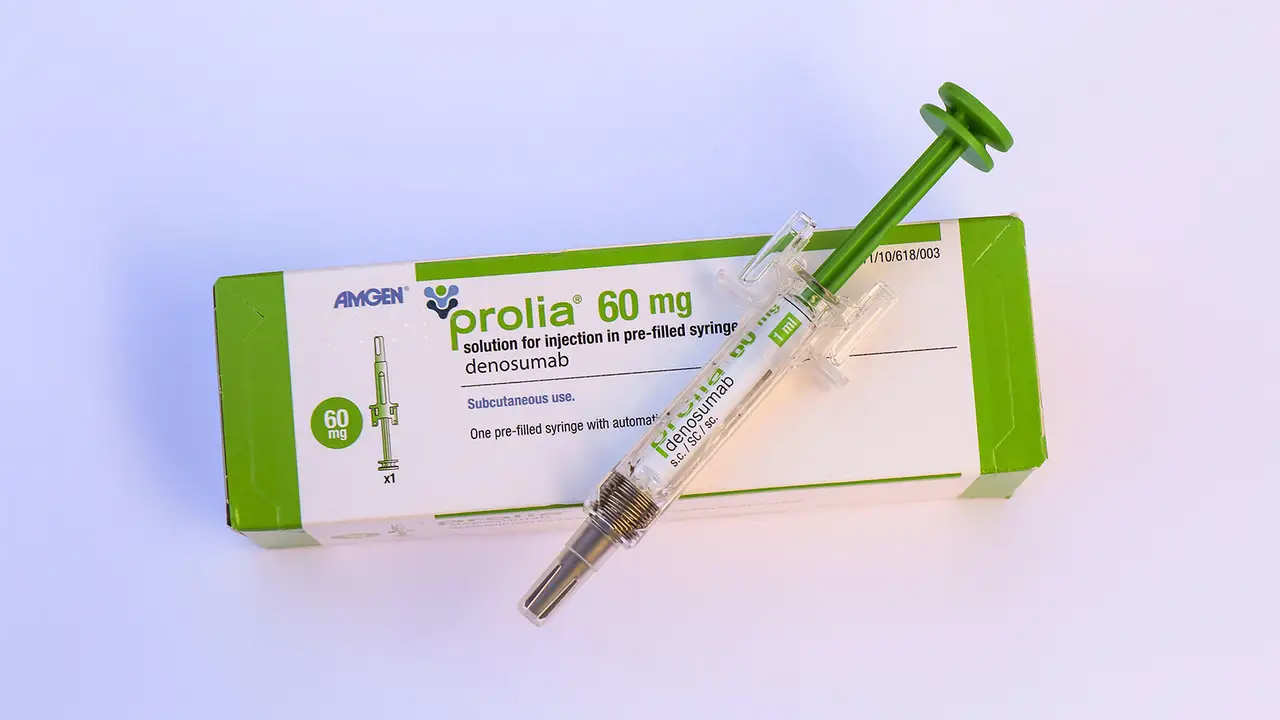
أضافت إدارة الغذاء والدواء الأمريكية تحذيرا يتعلق بدواء هشاشة العظام دينوسوماب (بروليا) بشأن خطر نقص كلس الدم الحاد لدى المرضى الذين يعانون من مرض الكلى المزمن المتقدم (CKD) .
بعد مراجعة الأدلة ، بما في ذلك البيانات الجديدة المنشورة في JAMA ، قررت إدارة الغذاء والدواء أن دينوسوماب Denosumab يمكن أن يزيد من خطر الإصابة بنقص كلس الدم الشديد مقارنة بالبايفوسفونيت في المرضى الذين يعانون من مرض الكلى المزمن المتقدم ، وخاصة أولئك الذين يخضعون لغسيل الكلى. المرضى الذين يخضعون لغسيل الكلى أو الذين يعانون من اضطرابات المعادن والعظام (MBD) هم الأكثر عرضة لخطر انخفاض مستويات الكالسيوم في الدم.
وأظهرت البيانات الجديدة، التي شملت النساء اللواتي يخضعن لغسيل الكلى، أن 41٪ أصبن بنقص كلس الدم الحاد خلال الأسابيع الـــ 12 الأولى من علاج دينوسوماب، مقارنة بــ 2.0٪ من أولئك الذين تناولوا البايفوسفونيت عن طريق الفم.
التحذير “الأبرز”
يتضمن احتمال حدوث ضرر جسيم من نقص كلس الدم الشديد. يمكن أن يشمل ذلك دخول المستشفى ، والأحداث التي تهدد الحياة ، والوفاة في المرضى الذين يعانون من مرض الكلى المزمن المتقدم الذين يتناولون دينوسوماب. يمكن أن يكون نقص كلس الدم الشديد بدون أعراض أو يمكن أن يظهر مع أعراض مثل الارتباك أو النوبات أو عدم انتظام ضربات القلب أو الإغماء أو ارتعاش الوجه أو تشنجات العضلات غير المنضبط أو الضعف أو الوخز أو التنميل في أجزاء من الجسم.
السلامة أولا
بشأن سلامة الأدوية ، نصحت إدارة الغذاء والدواء الأمريكية الأطباء باختيار المرضى المناسبين بعناية لهذا العلاج وزيادة مراقبة مستويات الكالسيوم في الدم ، خاصة في الأسابيع 2 إلى 10 الأولى بعد كل حقنة. قد تكون هناك حاجة أيضا مكملات الكالسيوم وفيتامين (د).
قبل وصف دينوسوماب ، يجب على الأطباء تقييم وظائف الكلى لمرضاهم والنظر في خطر نقص كلس الدم الشديد مع دينوسوماب في سياق العلاجات الأخرى المتاحة لهشاشة العظام للمرضى الذين يعانون من مرض الكلى المزمن المتقدم – وخاصة أولئك الذين يخضعون لغسيل الكلى.
“إذا كان البروليا لا يزال قيد النظر لهؤلاء المرضى ، للاستخدام الأولي أو المستمر ، تحقق من مستويات الكالسيوم في الدم وقم بتقييمها بحثا عن دليل على CKD-MBD” ، وفقا لما تنصح به إدارة الغذاء والدواء.
يجب على المرضى الذين يتناولون دينوسوماب عدم التوقف عن تناول الأدوية دون استشارة مقدم الرعاية الصحية أولا.
تحديث التحذيرات
يأتي تحديث الملصق بعد أن أصدرت إدارة الغذاء والدواء الأمريكية في البداية تنبيها للسلامة في نوفمبر 2022 حول خطر نقص كلس الدم المحتمل للدينوسوماب لدى النساء المعتمدات على غسيل الكلى. تم دفع تنبيه السلامة بعد النتائج المؤقتة من دراسة السلامة المستمرة لشركة Amgen – المطلوبة عند الموافقة – والتي أشارت إلى زيادة خطر الإصابة بنقص كلس الدم لدى المرضى الذين يعانون من أمراض الكلى المتقدمة.
تمت الموافقة على الدواء لأول مرة في عام 2010 للنساء بعد انقطاع الطمث المصابات بهشاشة العظام المعرضات لخطر كبير للإصابة بكسور العظام والتقطت لاحقا مؤشرات لعلاج الرجال المصابين بهشاشة العظام وهشاشة العظام التي يسببها الجلوكوكورتيكويد وفقدان العظام لدى أولئك الذين يتلقون علاج الحرمان من الأندروجين لسرطان البروستاتا وللنساء اللائي يتلقين العلاج بمثبطات الأروماتاز لسرطان الثدي.
(تمت الموافقة على دينوسوماب أيضا تحت الاسم التجاري Xgeva لتقليل مخاطر الأحداث المتعلقة بالعظام لدى بعض مرضى السرطان.)
يتم إعطاء العلاج عن طريق الحقن كل 6 أشهر ، ويعمل عن طريق منع منشط مستقبلات البروتين للعامل النووي كابا بيتا (RANK) ويمنع الخلايا الآكلة للعظم من تكسير العظام في الجسم.
طلبت إدارة الغذاء والدواء الأمريكية من المرضى والمتخصصين في الرعاية الصحية الإبلاغ عن الآثار الجانبية التي تنطوي على دينوسوماب إلى برنامج MedWatch التابع للوكالة.
المصدر:
FDA Slaps Boxed Warning on Osteoporosis Drug | MedPage Today

 المنتدى الصحي5 years ago
المنتدى الصحي5 years ago
 المنتدى الصحي3 years ago
المنتدى الصحي3 years ago
 أعراض وأمراض5 years ago
أعراض وأمراض5 years ago
 الغذاء قبل الدواء3 years ago
الغذاء قبل الدواء3 years ago
 الغذاء قبل الدواء4 years ago
الغذاء قبل الدواء4 years ago
 صوت وصورة4 years ago
صوت وصورة4 years ago
 الغذاء قبل الدواء4 years ago
الغذاء قبل الدواء4 years ago